
Hola amigo(a), si tú quieres aprender sobre Física Moderna, has escogido el Blog PERFECTO PARA HACERLO!
lunes, 5 de noviembre de 2012
domingo, 4 de noviembre de 2012
ONDAS DE LOUIS DE BROGLIE
Ondas de De Broglie
En un trabajo publicado en 1924, De Broglie partía de una comparación entre las propiedades del fotón y el electrón para suponer que esta última partícula podría poseer relaciones de energía-frecuencia y longitud de onda-momento lineal análogas a la primera, y expresadas como:

siendo un vector unitario que comparte dirección y sentido con el vector de onda
un vector unitario que comparte dirección y sentido con el vector de onda  .
.


siendo
 un vector unitario que comparte dirección y sentido con el vector de onda
un vector unitario que comparte dirección y sentido con el vector de onda  .
.
Partiendo de las hipótesis relativistas, se podría establecer una equivalencia entre energía y el momento lineal del electrón considerado como onda y como partícula material, de lo que se deduciría que:

Longitud de onda de De Broglie
De la comparación de las magnitudes del comportamiento del electrón entendido como onda y como partícula, se obtiene un valor para la longitud de onda que tendría el movimiento ondulatorio asociado al electrón que viene dado por:

donde v es la velocidad de la partícula y m su masa. Esta magnitud, llamada longitud de onda de De Broglie, aumenta al disminuir la velocidad, y a la inversa.
De la comparación de las magnitudes del comportamiento del electrón entendido como onda y como partícula, se obtiene un valor para la longitud de onda que tendría el movimiento ondulatorio asociado al electrón que viene dado por:

donde v es la velocidad de la partícula y m su masa. Esta magnitud, llamada longitud de onda de De Broglie, aumenta al disminuir la velocidad, y a la inversa.
ESPECTRO DE EMISIÓN Y ABSORCIÓN
Emisión:
Espectro de emisión: Es el producido por cualquier tipo de manantial de luz, si se trata de un sólido incandescente produce un espectro de luz continuo que contiene todas las longitudes de onda comprendidas entre sus dos límites.
• Cuando un gas es excitado eléctrica o térmicamente emite un espectro de líneas característicos de el.
• La formación del espectro de líneas de cada elemento se debe a que los electrones emiten cantidades definidas de energía.
• La luz se origina cuando los electrones están excitados y pasan de un nivel menor a uno mayor y luego regresan a su nivel original liberando su exceso de energía emitiéndola en forma de radiación electromagnética que esto es igual a una luz monocromática con una longitud de onda perfectamente bien definida
• Todo elemento tiene su espectro característico, osease único como por ejemplo las huellas digitales de los humanos.
• Los átomos de sodio gaseosos emiten una serie de líneas básicamente amarillas. Las cuales son tan inconfundibles como las otras líneas producidas por los átomos de otros elementos.
• El origen del espectro de un electrón se encuentra en sus átomos

Absorción:
El efecto de absorción ocurre cuando un cuerpo que emite un espectro continuo se le interpone un gas antes de llegar la luz al espectroscopio.
• Cualquier sustancia absorbe el mismo tipo de luz que la que emite.
• Como el gas absorbe todas las longitudes de onda de igual espectro de emisión, al espectro resultante se le notaran unas líneas negras en los sitios correspondientes a las líneas características del espectro de emisión del gas absorbente.
• Los espectros de absorción, nos permite realizar análisis espectrograficos, por ejemplo cuando queremos conocer la composición de un astro carente de luz propia pero que refleja la del sol se toma un espectrograma de su luz.
Espectro de emisión: Es el producido por cualquier tipo de manantial de luz, si se trata de un sólido incandescente produce un espectro de luz continuo que contiene todas las longitudes de onda comprendidas entre sus dos límites.
• Cuando un gas es excitado eléctrica o térmicamente emite un espectro de líneas característicos de el.
• La formación del espectro de líneas de cada elemento se debe a que los electrones emiten cantidades definidas de energía.
• La luz se origina cuando los electrones están excitados y pasan de un nivel menor a uno mayor y luego regresan a su nivel original liberando su exceso de energía emitiéndola en forma de radiación electromagnética que esto es igual a una luz monocromática con una longitud de onda perfectamente bien definida
• Todo elemento tiene su espectro característico, osease único como por ejemplo las huellas digitales de los humanos.
• Los átomos de sodio gaseosos emiten una serie de líneas básicamente amarillas. Las cuales son tan inconfundibles como las otras líneas producidas por los átomos de otros elementos.
• El origen del espectro de un electrón se encuentra en sus átomos

Absorción:
El efecto de absorción ocurre cuando un cuerpo que emite un espectro continuo se le interpone un gas antes de llegar la luz al espectroscopio.
• Cualquier sustancia absorbe el mismo tipo de luz que la que emite.
• Como el gas absorbe todas las longitudes de onda de igual espectro de emisión, al espectro resultante se le notaran unas líneas negras en los sitios correspondientes a las líneas características del espectro de emisión del gas absorbente.
• Los espectros de absorción, nos permite realizar análisis espectrograficos, por ejemplo cuando queremos conocer la composición de un astro carente de luz propia pero que refleja la del sol se toma un espectrograma de su luz.
EFECTO COMPTON
El Efecto Compton fue estudiado por el físico Arthur Compton en 1923
El efecto Compton consiste en el aumento de la longitud de onda de un fotón de rayos X cuando choca con un electrón libre y pierde parte de su energía. La frecuencia o la longitud de onda de la radiación dispersada depende únicamente de la dirección de dispersión. El desplazamiento de la longitud de onda de los fotones no depende por tanto de la naturaleza del medio en el que se produce la dispersión, sino únicamente de la masa de la partícula que deflecta el fotón (generalmente electrones) y de la dirección de deflexión.
Puede demostrarse a partir del principio de conservación del ímpetu o momento lineal y de la conservación de la energia total que el corrimiento de longitud de onda del fotón viene dado, en función del ángulo de dispersión del fotón respecto a la dirección incidente
 , supuesta colisión con un electrón:
, supuesta colisión con un electrón:
Que corresponde a una pérdida energética del fotón dada por:

Frecuentemente se define la longitud de onda Compton como  .
.
El efecto compton es un proceso inelástico, por el cual se modifica tanto la dirección como la energía del fotón, en oposición a la dispersión Rayleigh en la que la energia del fotón permanece constante aunque cambia su dirección.
El efecto Compton es predominante a energias del orden de 1 MeV, disminuyendo su sección eficaz con la inversa de la energia para valores altos de esta.

Efecto Compton inverso
Cuando los fotones chocan con electrones relativistas, pueden ganar inverso. Este efecto puede ser una de las explicaciones de la emisión de rayos X en supernovas, quasars y otros objetos astrofísicos de alta energía.

 .
.El efecto compton es un proceso inelástico, por el cual se modifica tanto la dirección como la energía del fotón, en oposición a la dispersión Rayleigh en la que la energia del fotón permanece constante aunque cambia su dirección.
El efecto Compton es predominante a energias del orden de 1 MeV, disminuyendo su sección eficaz con la inversa de la energia para valores altos de esta.
Efecto Compton inverso
Cuando los fotones chocan con electrones relativistas, pueden ganar inverso. Este efecto puede ser una de las explicaciones de la emisión de rayos X en supernovas, quasars y otros objetos astrofísicos de alta energía.

POSTULADO DE MAX PLANK

Aunque en un principio fue ignorado por la comunidad científica, profundizó en el estudio de la teoría del calor y descubrió, uno tras otro, los mismos principios que ya había enunciado Josiah Willard Gibbs (sin conocerlos previamente, pues no habían sido divulgados). Las ideas de Clausius sobre la entropía ocuparon un espacio central en sus pensamientos.
En 1889, descubrió una constante fundamental, la denominada constante de Planck, usada para calcular la energía de un fotón. Esto significa que la radiación no puede ser emitida ni absorbida de forma continua, sino solo en determinados momentos y pequeñas cantidades denominadas cuantos o fotones. La energía de un cuanto o fotón depende de la frecuencia de la radiación:
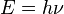 ó
ó 
donde h es la constante de Planck (su valor es 6,62 por 10 elevado a -34 julios por segundo o también 4,13 por 10 elevado a -15electronvoltios por segundo); V frecuencia de la onda lumínica.
2da formúla: donde c es la velocidad de la Luz y λ longitud de onda.
Un año después descubrió la ley de radiación del calor, denominada Ley de Planck, que explica el espectro de emisión de un cuerpo negro. Esta ley se convirtió en una de las bases de la mecánica cuántica, que emergió unos años más tarde con la colaboración de Albert Einstein y Niels Bohr, entre otros.
PRINCIPIO DE INCERTIDUMBRE DE HEISENBERG
El también llamado principio de indeterminación constituye uno de los puntales de la teoría cuántica. El principio formulado por el alemán Werner Heisenberg demuestra que a nivel cuántico no es posible conocer de forma exacta el momento lineal y la posición de una partícula. O de forma más correcta, que es imposible conocer dichos valores más allá de cierto grado de certidumbre. A nivel cuántico las partículas no son pequeñas esferas, sino borrones. Si es posible fijar la posición de la partícula con total precisión será imposible conocer su velocidad. Si por el contrario se conoce su velocidad, no se sabrá a ciencia cierta en qué punto se halla.
Esto tiene un curioso colorario, que no se observa en el mundo macroscópico: la acción del observador altera el sistema observado. El principio de incertidumbre tiene además consecuencias curiosas, tales como el efecto túnel, y es también la causa de que se hallan desarrollado conceptos tales como los orbitales atómicos.
EFECTO FOTOELÉCTRICO
Una placa de zinc recién pulida, cargada negativamente, pierde su carga si se la expone a la luz ultravioleta. Este fenómeno se llama efecto fotoeléctrico.

Investigaciones cuidadosas, hacia finales del siglo diecinueve, prueban que el efecto fotoeléctrico sucede también con otros materiales, pero sólo si la longitud de onda es suficientemente pequeña. El efecto fotoeléctrico se observa por debajo de algún umbral de longitud de onda que es específica del material. El hecho de que la luz de longitud de onda elevada no tuviera ningún efecto, incluso si es extremadamente intensa, aparecía como algo especialmente misterioso para los científicos.

Finalmente Albert Einstein dió la explicación en 1905: La luz está constituida por partículas (photones), y la energía de tales partículas es proporcional a la frecuencia de la luz. Existe una cierta cantidad mínima de energía (dependiendo del material) que es necesaria para extraer un electrón de la superficie de una placa de zinc u otro cuerpo sólido (función trabajo). Si la energía del fotón es mayor que este valor el electrón puede ser emitido. De esta explicación obtenemos la siguiente expresión:
| Ecin = h f − W |
Ecin ... energía cinética máxima de un electrón emitido
h ..... constante de Planck (6.626 x 10−34 Js)
f ..... frecuencia
W ..... función trabajo
h ..... constante de Planck (6.626 x 10−34 Js)
f ..... frecuencia
W ..... función trabajo
MODELO ATÓMICO DE BOHR
| En 1913 Bohr publicó una explicación teórica para el espectro atómico del hidrógeno. Basándose en las ideas previas de Max Plank, que en 1900 había elaborado una teoría sobre la discontinuidad de la energía (Teoría de los cuantos), Bohr supuso que el átomo solo puede tener ciertos niveles de energía definidos. Bohr establece así, que los electrones solo pueden girar en ciertas órbitas de radios determinados. Estas órbitas sonestacionarias, en ellas el electrón no emite energía: la energía cinética del electrón equilibra exactamente la atracción electrostática entre las cargas opuestas de núcleo y electrón. El electrón solo puede tomar así los valores de energía correspondientes a esas órbitas. Los saltos de los electrones desde niveles de mayor energía a otros de menor energía o viceversa suponen, respectivamente, una emisión o una absorción de energía electromagnética (fotones de luz). |
Sin embargo el modelo atómico de Bohr también tuvo que ser abandonado al no poder explicar los espectros de átomos más complejos. La idea de que los electrones se mueven alrededor del núcleo en órbitas definidas tuvo que ser desechada. Las nuevas ideas sobre el átomo están basadas en la mecánica cuántica, que el propio Bohr contribuyó a desarrollar. |
Suscribirse a:
Entradas (Atom)

